News Detail
 来源:2024-11-26 15:48:17
来源:2024-11-26 15:48:17
 浏览量:18037
浏览量:18037

EGFR是表皮生长因子受体(HER)家族成员之一,是细胞增殖、分化和存活的主要调节因子。在未刺激条件下,EGFR以无活性单体形式存在。然而,在配体结合后,它可以与其他 EGFR 家族蛋白形成同源二聚体或异二聚体。受体二聚化对于 EGFR 的 C 端尾部特异性酪氨酸残基的激酶激活和磷酸化至关重要。在脑肿瘤中经常观察到高丰度的EGFR 和大的内部缺失,而激酶结构域内的点突变和小插入在肺癌中很常见,由于 EGFR 在多种癌症类型中经常过表达和/或突变,因此是许多特异性靶向疗法开发的靶点。
爱思益普已表达纯化EGFR系列活性蛋白可供选择

蛋白产品案例展示:EGFR[d746-750/T790M/C797S]
A:生产流程:

图2. EGFR[d746-750/T790M/C797S]生产流程图
B:常规QC结果:
SDS-PAGE检测EGFR[d746-750/T790M/C797S]的纯度在90%以上。

图3. EGFR[d746-750/T790M/C797S] SDS-PAGE结果图
C:活性验证结果:
HTRF法对EGFR[d746-750/T790M/C797S]蛋白分别进行酶滴和阳性药的验证,EGFR[d746-750/T790M/C797S]具有良好的活性,满足实验需求。
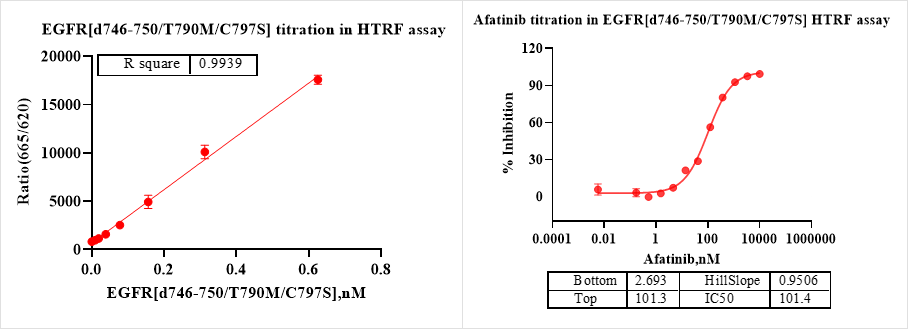
图4. HTRF法活性测定

图5. Afatinib, Osimertinib,BLU-945 和EAI-045在EGFR[L858R/T790M]和EGFR上的IC50结果
爱思益普EGFR系列蛋白产品列表

更多产品信息请访问爱思益普蛋白商城查询:https://protein.ice-biosci.com/
除了丰富的现货产品,同时可以提供克隆-表达-纯化-质控-活性测定一体化蛋白定制服务。以满足您对蛋白序列、标签或修饰以及不同应用场景的个性化需求。
EGFR 背景介绍
1、简介
EGFR(Epidermal Growth Factor Receptor)是上皮生长因子(EGF)细胞增殖和信号传导的受体。EGFR属于ErbB受体家族的一种,该家族包括EGFR,HER2,HER3和HER4。EGFR也被称作HER1、ErbB1,突变或过表达一般会引发肿瘤。EGFR是一种糖蛋白,属于酪氨酸激酶型受体。EGFR位于细胞膜表面,靠与配体结合来激活,包括EGF和TGFα。激活后,EGFR由单体转化为二聚体。EGFR二聚后可以激活它位于细胞内的激酶通路,包括Y992, Y1045, Y1068, Y1148 and Y1173等激活位点。这个自磷酸化可以引导下游的磷酸化,包括MAPK,Akt和JNK通路, 诱导细胞增殖。受体激活对于皮肤的免疫来说很重要。研究表明在许多实体肿瘤中存在EGFR的高表达或异常表达。EGFR与肿瘤细胞的增殖、血管生成、肿瘤侵袭、转移及细胞凋亡的抑制有关。
EGFR受体可激活三个信号通路:参与免疫调节的JAK/STAT信号通路,参与细胞增殖的RAS-RAF-MEK途径(MAPK/ERK通路),以及参与细胞存活的PI3K-AKT-mTOR途径。RAS-RAF-MEK途径负责控制基因转录活动和细胞循环周期,而PI3K-AKT-mT0R途径可激活抗细胞凋亡的信号。因此,EGFR受体蛋白在细胞增殖及存活上有着非常重要的作用。三种信号通路是细胞内信号转导的基础,调控肿瘤细胞诸多生理变化如:分裂、分化、生长以及迁移等。

图6.EGFR受体蛋白激活JAK-STAR、RAS-RAF-MEK和PI3K-AKT-mTOR信号通路示意图
2、蛋白结构
EGFR的结构EGFR是一个含有1186个氨基酸的跨膜糖基化蛋白,其结构由三个部分组成:胞外结构域(N端),穿膜结构域(TM,疏水的α螺旋结构)和胞内结构域(JM、TK、C端)。胞外区为N端的621个氨基酸残基,包含配体EGF的结合域,并进一步细分为Ⅰ至Ⅳ区域;跨膜区由23个氨基酸残基构成螺旋状结构的疏水区,通过一个脯氨酸与胞外区相连,将受体固定于胞膜上;胞内区共用542个氨基酸残基,分为近膜区、酪氨酸蛋白激酶区和C末端3部分。
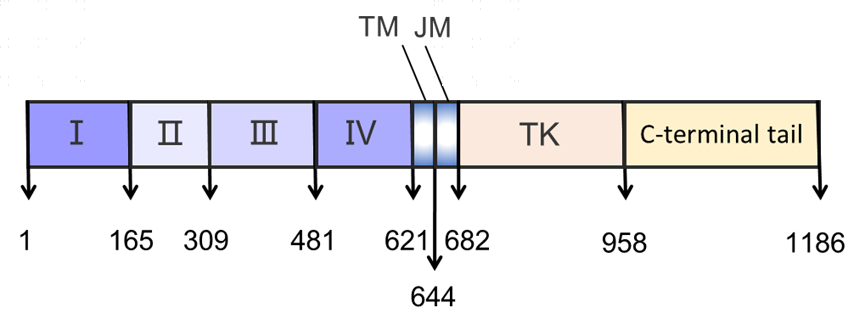
图7. EGFR结构示意图
3、抑制剂研究进展
从第一个EGFR-TKI研制出来到现在几十年,已有十多种EGFR-TKIs应用于临床治疗NSCLC。但分子靶向药物治疗出现的耐药现象,为癌症患者后续治疗带来了挑战。充分了解耐药机制设计开发新一代EGFR-TKIs潜力巨大,如第四代变构抑制剂的一个潜在优势是避免了与细胞内ATP竞争与催化位点的结合,从而增加了开发更强效和更特异抑制剂的可能性。EGFR-TKIs与其它药物的联合使用可以阻断多个信号通路,具有协同增效的作用,但联合用药临床获益还有待更多的研究论证。



扫一扫关注
爱思益普公众号


业务咨询
北京
业务咨询专线:010-6780-9840
联系地址:北京市经济技术开发区科创十三街18号院锋创科技园16号楼
上海
业务咨询专线:010-6780-9840
联系地址:上海市浦东新区蔡伦路780号新技术推广大楼3E5O室
徐州
业务咨询专线:010-6780-9840
联系地址:江苏省徐州市云龙区淮海文博园 二号楼2层
贵州
业务咨询专线:010-6780-9840
联系地址:贵州省贵阳市南明区龙岭路50号 欧美医药产业园一期2号楼



